3.2 ARN de interferencia
3.2 ARN de interferencia
El ARN de interferencia es un potente mecanismo de silenciamiento postraduccional, ya que puede remodelar la cromatina, bloquear la síntesis de proteínas, unirse específicamente a ARNm e incluso degradarlo. Se le atribuye el 20-30% de las variaciones del genoma.
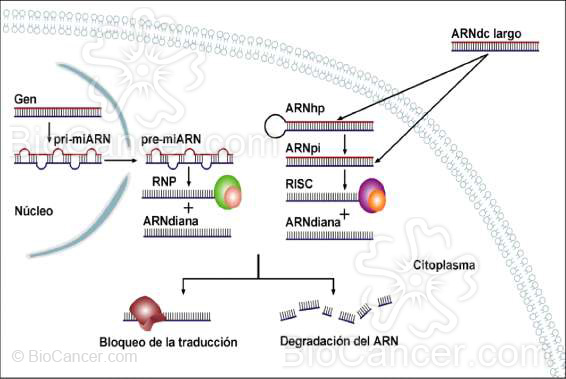
Figura 3.- ARN de interferencia
El proceso de interferencia puede ser activado por dos tipos de moléculas:
El ARNi ha dado buenos resultados como silenciador de genes que expresan proteínas oncogénicas como Brc-Ab1, característica de la leucemia mieloide crónica (LMC).
Seha conseguido regular selectivamente la expresión tanto con ARN interferente pequeño (ARNip), como con ARN en horquilla pequeño (ARNhp).
El principal problema que presenta el ARNi es la vía de administración. Es necesario que penetre en tejidos y células a una concentración terapéuticamente efectiva. Para ello es necesario realizar modificaciones estructurales que le confieran mayor resistencia a las nucleasas séricas y un tiempo de vida prolongado en los modelos animales.
Muchos oncogenes son potenciales dianas para el tratamiento con ARNi. En líneas celulares HeLa, la expresión de oncogenes como bcl-2, cdk-2 o vegf se ve disminuida al transfectar ARNip (Yin et al, 2003).
El ARNi también ha sido usado para estudiar la supervivencia de las células tumorales y la apoptosis. Se ha empleado ARNi para silenciar bcl-2 y bcl-x en clones tipo p53+/+, p53-/-, Bax+/- y Bax-/- de células de cáncer colorrectal. De esta manera se ha observado una nueva función proapoptótica de p53, la cual no requiere activación por agentes genotóxicos y que está constitutivamente suprimida por bcl-2. El silenciamiento de bcl-2 induce una apoptosis masiva dependiente de p53. Éste puede ser un mecanismo regulador clave de apotosis activada mediante bcl-2 en carcinoma colorrectal (Jiang, et al, 2003).
